近日,西华大学食品与生物工程学院“发酵调味品科学与工程”团队在美国化学学会(ACS)旗下的农林科学领域国际顶尖期刊《Journal of Agricultural and Food Chemistry》(Q1, IF:5.895)发表题为“Revealing the Secret of Umami Taste of Peptides Derived fromFermented Broad Bean Paste”的研究性论文,且被选为正封面(Front Cover)论文。西华大学2020级硕士研究生赵建华为论文第一作者,林洪斌副教授为论文通讯作者。该研究工作得到了四川省科学技术厅重大专项项目(2020YFN0151)和重庆市科学技术委员会(cstc2021jscx-cylhX0014)的资助。


成果介绍
郫县豆瓣是我国著名的传统调味品,其发酵过程可分为前发酵和后发酵,前发酵又称甜瓣子发酵。甜瓣子(蚕豆瓣)发酵是郫县豆瓣发酵过程中重要的过程之一,它决定了郫县豆瓣的风味和产品质量。之前的研究表明,游离氨基酸、有机酸和还原糖等物质在发酵蚕豆瓣的风味系统中起重要作用,而最近的研究结果表明,鲜味肽也有助于发酵蚕豆瓣的风味,然而发酵蚕豆瓣中鲜味肽的呈味机制尚不清楚。
因此,本研究通过分级超滤、RP-HPLC和UPLC-QTOFMS/MS从发酵的蚕豆瓣中分离和鉴定并固相合成了鲜味肽,然后对这些鲜味肽进行感官评估、鲜味增强、咸味增强和缺失实验。利用同源建模和计算机分子模拟来探究这些鲜味肽的呈味机制,并研究了鲜味肽与鲜味受体T1R1/T1R3的相互作用,通过缺失实验确定发酵蚕豆瓣中关键的味觉活性化合物。本研究为鲜味肽的有效筛选奠定了基础,并为探索鲜味调味品和改善发酵蚕豆瓣的风味提供了理论依据。
结果表明,基于数据库辅助和从头鉴定,从发酵的蚕豆瓣中鉴定并合成了10条新的呈味肽。随后的感官实验确定了八条为鲜味/鲜味增强和咸味增强肽(PK-8、NK-7、SR-7、SK-8、EK-12、DK-6、LR-5和GR-6)以及两条苦味肽(VR-10和AR-8)。其中,EK-12在水溶液中的阈值超过了近5年报道的大多数鲜味肽。同时,定量分析和缺失实验证实,游离氨基酸是发酵蚕豆瓣中关键的味觉活性化合物,鲜味肽也有助于发酵蚕豆瓣的鲜味提升。构建鲜味受体T1R1/T1R3同源模型用于分子对接,以探究鲜味肽的呈鲜机制。结果表明,8条鲜味肽可以很容易地进入T1R3中活性结构域(VFTD)口袋。受体T1R3中的Asp、Glu、Ser和His残基,特别是Glu301,可能在鲜味的产生中发挥关键作用,其主要通过氢键和静电相互作用与鲜味肽结合。此外,受体与鲜味肽相互作用表面力以芳香相互作用、氢键、亲水作用和SAS为主。本研究利用分子对接,基于能量相互作用和表面力分析,全面了解了鲜味肽的味觉机制。研究结果为发酵酱类制品中小分子肽的分离、功能评价及机制研究提供了借鉴思路,有助于对天然发酵酱类食品风味系统的理解。

图形摘要(TOC graphic)
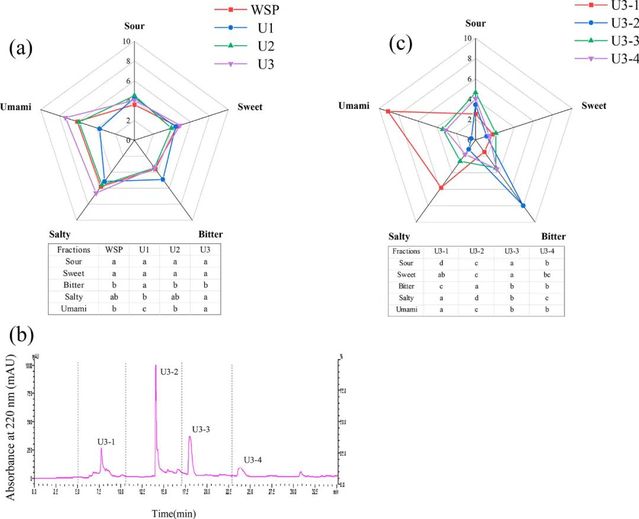
Figure 1. (a) Taste profile of WSP and its ultrafiltration fractions by sensory evaluation. (b) Elution profile by RP-HPLC for fraction U3. (c) Tasteprofile of RP-HPLC fractions by sensory evaluation. (values not sharing the common lowercase letters within the same line are significantly different, *p < 0.05)
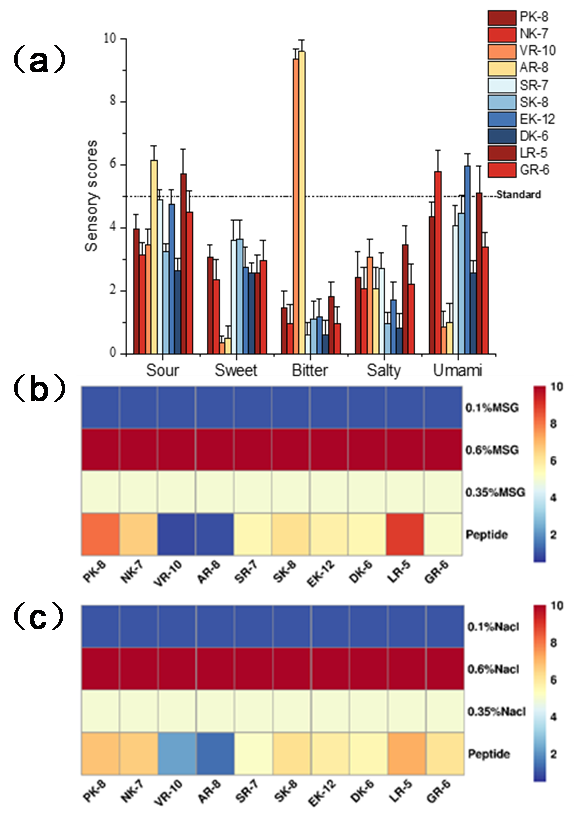
Figure 2. Taste characterization of synthetic peptides. (a) Tasteprofile of umami peptides. (b,c) Umami and salty enhancementevaluation of synthetic peptides.

Figure 3. Structure and reliability of the homology model of T1R1/T1R3. (a) Structure of T1R1/T1R3. (b) Raman map of T1R1/T1R3. (c)Verify-3D of T1R1/T1R3.

Figure 4.Active site statistics of eight umami peptides interactingwith the VFTD structural domain of the umami receptor T1R1/T1R3.

Figure 5.2D diagram of umami peptides with T1R1/T1R3. The residues are shown as balls with different colors. The interaction forces areexpressed as an imaginary line.

Figure 6. Surface force analysis of T1R1/T1R3 interacting with umami peptides.

林洪斌,工学博士,副教授,硕士生导师,长期从事农产品加工及风味化学研究,近5年发表相关学术论文20余篇,其中SCI收录论文14篇,获授权发明专利7项。参与完成省级成果评价3项,获得四川省科技进步三等奖一项,四川省食品工业科学技术二等奖一项,郫县科技进步一等奖一项。其所在发酵调味品科学与工程团队长期专注于以郫县豆瓣、四川泡菜为代表的四川地方特色发酵食品的相关研究,合作企业达40余家,共建国家企业技术中心、国家工程实验室、川渝共建重庆市重点实验室及食品微生物四川省重点实验室等国家和省部级平台6个,校企联合实验室12个。先后承担并完成国家级和省部级等各类课题50余项,获得中国轻工业联合会、四川省科技进步奖和成都市科技进步奖7项,发表学术论文200余篇,获得授权发明专利20余项。

赵建华,食品与生物工程学院2020级硕士研究生。主要研究方向为发酵工程。目前共发表SCI论文3篇,其中以第一作者身份发表2篇SCI论文(中科院一区),参与省部级科研项目1项,获四川省学科竞赛三等奖1项。






 川公网安备 51010602000503号
川公网安备 51010602000503号